Vom Syndrom der leeren Follikel (SLF) spricht man, wenn nach der Follikelpunktion keine Eizellen entnommen werden. Diese Veränderung tritt bei einem kleinen Prozentsatz der Frauen auf, die für einen Zyklus der assistierten Reproduktion stimuliert werden, und wenn die Follikel abgesaugt werden, um die Eizellen zu gewinnen, werden sie nicht gefunden.
Dieses Syndrom wurde erstmals 1986 von Coulam beschrieben und ist seither bekannt. Die Ursachen für das Syndrom der leeren Follikel sind jedoch nicht bekannt.
In diesem Artikel gehen wir darauf ein, was das VMS charakterisiert und wie man es erkennt, sowie auf die möglichen Behandlungen oder Lösungen, die es für dieses Syndrom gibt.
Im Anschluss finden Sie ein Inhaltsverzeichnis mit allen Punkten, die wir in diesem Artikel behandeln.
- 1.
- 1.1.
- 1.2.
- 2.
- 3.
- 3.1.
- 3.2.
- 3.3.
- 3.4.
- 3.5.
- 4.
- 5.
- 6.
Syndrom der leeren Follikel
Bei der Punktion der Eierstöcke aspiriert der Gynäkologe die Follikel, um die Eizellen zu entnehmen, damit sie im Labor gewonnen werden können. Bei Patientinnen mit SLF löst sich die Eizelle jedoch nicht von der Follikelwand und wird nicht aspiriert.
SLF ist während der ovariellen Stimulation nicht nachweisbar, da es durch ein gutes Follikelwachstum während der gesamten Überwachungsphase und einen angemessenen Östradiolspiegel im Blut gekennzeichnet ist. Aus diesem Grund treten bei diesem Syndrom bis zum Zeitpunkt der Punktion keine Symptome auf.
Die Ursachen für VSLF lassen sich nach ihrem Ursprung in zwei Hauptgruppen einteilen: aufgrund eines Versagens bei der Verabreichung der Behandlungsmedikation oder aufgrund intrinsischer Ursachen des Patienten.
Syndrom der falschen leeren Follikel
Falsche VFS sind auf Fehler oder Anomalien bei den Medikamenten zurückzuführen, die zur Stimulation der Eierstöcke verabreicht werden.
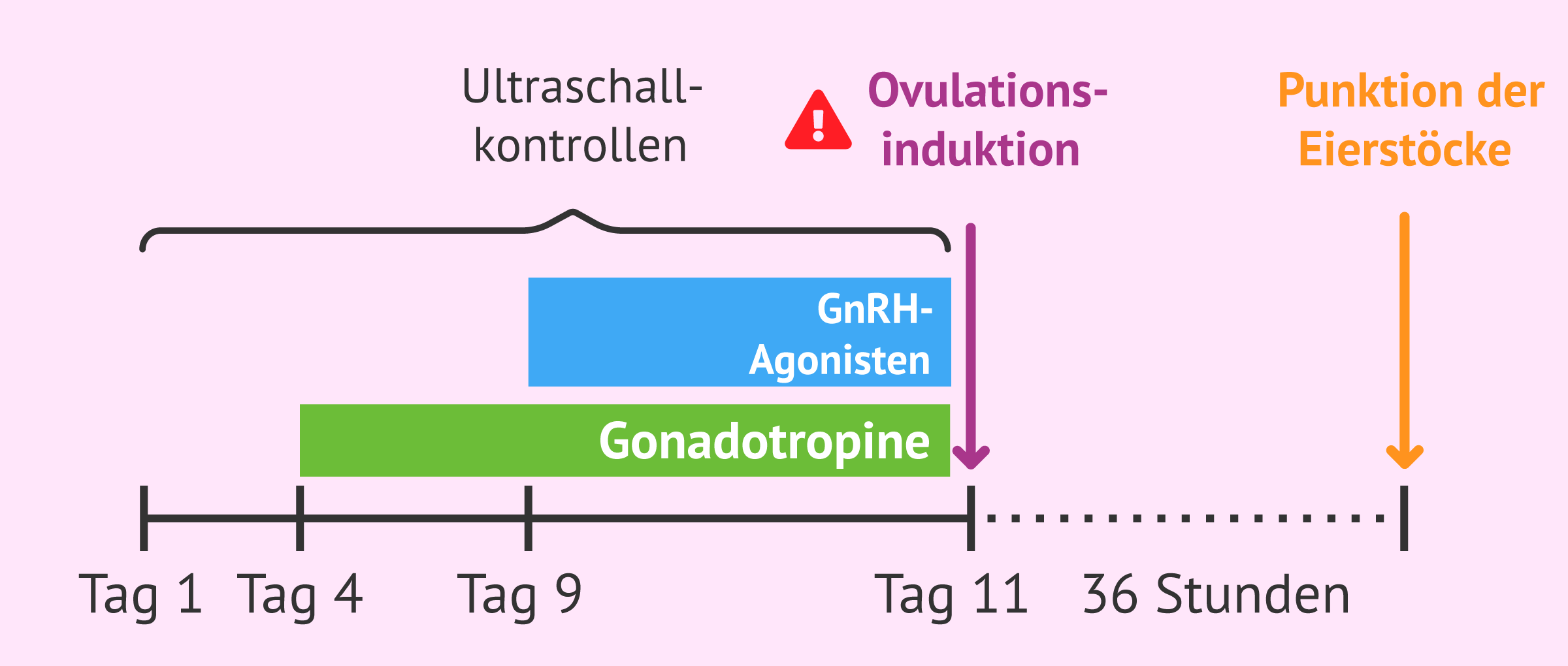
Wenn die Follikel während der Stimulationsphase einen optimalen Durchmesser erreicht haben, wird die Frau auf die Punktion vorbereitet. Zu diesem Zweck wird der Frau hCG verabreicht, das auch als Trigger bezeichnet wird und die Schwangerschaft fördert:
- Die Reifung der Eizelle ist notwendig, damit die Befruchtung der Eizelle möglich ist.
- Die Ablösung der Eizelle von der Follikelwand, da sie Veränderungen in der Struktur des Bindegewebes verursacht, die es lockerer machen.
- Der Eisprung, d. h. die Freisetzung der Eizelle in den weiblichen Fortpflanzungstrakt, findet normalerweise etwa 40 Stunden nach der Verabreichung des Triggersstatt. Dieses Ereignis ist jedoch nicht erwünscht und sollte unbedingt vermieden werden.
Aus diesem Grund wird der Zeitpunkt der Punktion 36 Stunden nach der Injektion gewählt, wenn die Eizelle schätzungsweise herangereift ist, der Eisprung aber noch nicht stattgefunden hat.
Fehler bei der Zeit, dem Tag oder der Art der Verabreichung des Triggers können dazu führen, dass die 35-36 Stunden, die für die Reifung der Eizelle benötigt werden, nicht korrekt sind und bei der Punktion der Eierstöcke keine Eizellen gewonnen werden. Eine falsche Verabreichung dieses Arzneimittels kann auch dazu führen, dass der Hormonspiegel nicht ausreicht, um die Eizellreifung auszulösen.
Andere mögliche Fehler, die zum Empty-Follicle-Syndrom führen können, sind Anomalien im Trigger-Medikament selbst, da es veraltet sein oder eine verminderte Aktivität aufweisen kann und daher weniger Wirkung im Körper des Patienten entfaltet, da sein Wirkstoff verbraucht ist.
Echtes oder echtes Leer-Follikel-Syndrom
Von einem echten leeren Follikel-Syndrom spricht man, wenn das Stimulationsprotokoll und die Verabreichung des Triggers, das Follikelwachstum und die Östradiolspiegel während des gesamten Zyklus korrekt waren, jedoch keine Eizellen aus den durch die Ovarialpunktion entnommenen Follikeln gewonnen wurden.
Ein weiteres Merkmal, das uns vermuten lässt, dass wir es mit einem echten Fall von FVS zu tun haben, ist die Tatsache, dass die Patienten dazu neigen, auch in den nachfolgenden Zyklen auf dieselbe Weise zu reagieren.
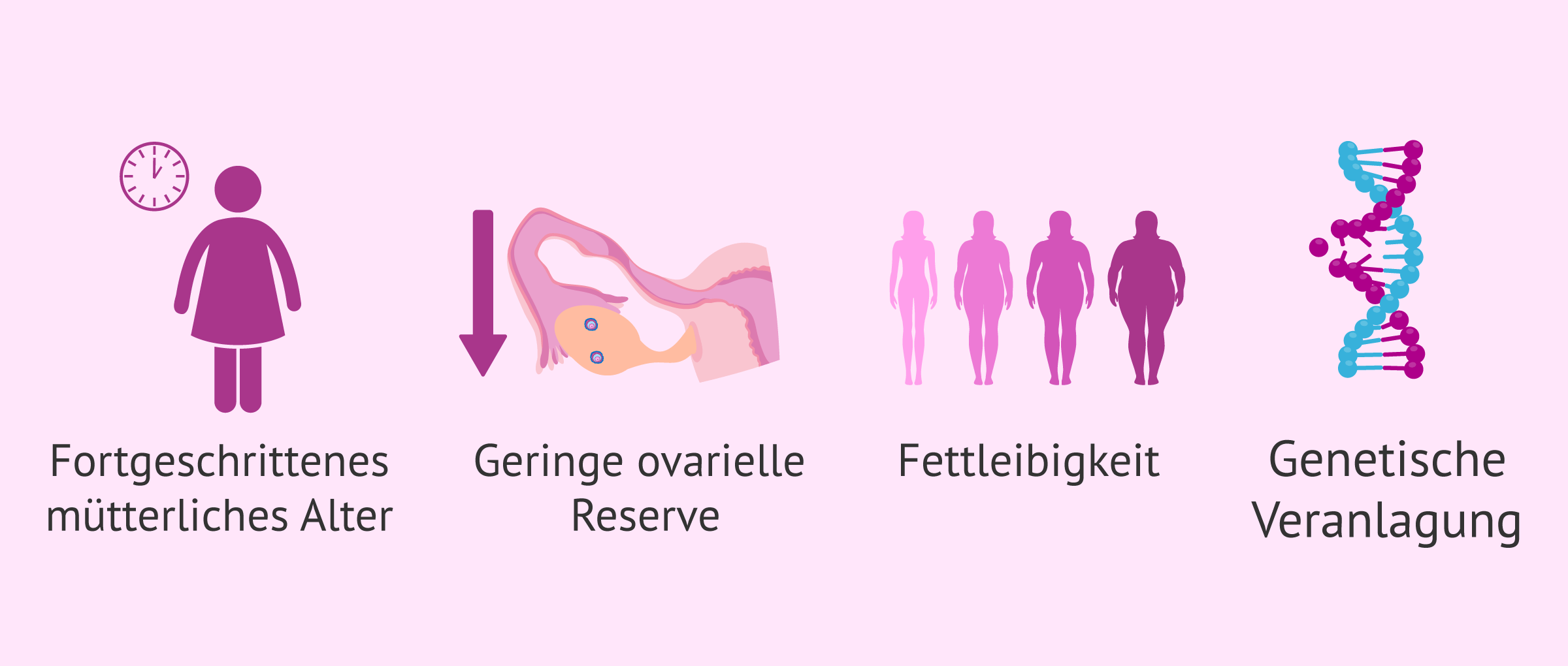
Obwohl die Ursache dieses Syndroms bei den Patientinnen nicht bekannt ist, hat man festgestellt, dass es bei Frauen über 40 Jahren, mit geringer Eierstockreserve oder Übergewicht viel häufiger auftritt. Diese Veränderung wird mit der Alterung der Eierstöcke sowie mit einer Störung des Wachstums und der Reifung der Follikel in Verbindung gebracht.
Andere mögliche Ursachen, die mit FVS in Verbindung stehen könnten, sind genetische Veränderungen, die für das Syndrom prädisponieren. Dies würde die Fälle des Empty-Follicle-Syndroms bei jungen Menschen erklären, die keine Veränderungen im Hormonstoffwechsel oder andere Ursachen haben, die zu VFS prädisponieren könnten.
Behandlung des Syndroms der leeren Follikel
Viele Studien haben die Frage der finanziellen Kosten und der moralischen Belastung durch VPS bei der assistierten Reproduktionsbehandlung aufgeworfen.
Glücklicherweise handelt es sich um ein seltenes Ereignis, das nur bei 0,5 % bis 7 % der stimulierten assistierten Reproduktionsbehandlungen auftritt.
Diejenigen Patienten, bei denen aufgrund von Fehlern bei der Verabreichung des Auslösers falsche VFS auftreten, können dies tun:
- Bestimmen Sie die hCG-Blutwerte, um festzustellen, ob sie korrekt sind oder ob eine neue hCG-Injektion erforderlich ist.
- Wiederholen Sie die Punktion, wenn die hCG-Gabe vor 36 Stunden erfolgte.
- Versuchen Sie einen neuen Zyklus der Eierstockstimulation, wobei Sie bei der Verabreichung von Medikamenten äußerste Vorsicht walten lassen und die Follikel bei der Punktion zweimal aspirieren.
Allerdings liegt nur in 1 % dieser Fälle eine echte VFS vor, und die Prognose ist schlecht. Aus diesem Grund empfehlen viele Kliniken, den Patientinnen einen Eizellspendezyklus als Alternative anzubieten, wenn bei mehreren Stimulationszyklen keine reifen Eizellen gewonnen werden konnten.
Die assistierte Reproduktion erfordert, wie jede medizinische Behandlung, dass Sie der Professionalität der Ärzte und der Klinik, die Sie wählen, vertrauen, denn natürlich ist jede von ihnen anders.
Dieses "Tool" schickt Ihnen einen auf Sie zugeschnittenen Bericht zu, mit allen dazugehörigen Informationen zu den passenden Behandlungen, Kliniken in Ihrer Nähe die unsere strengen Qualitätskriterien erfüllen sowie deren Kostenvoranschläge. Außerdem erhalten Sie wertvolle Tipps zu Ihrem ersten Besuch in der Kinderwunschklinik.
Andere Studien haben die In-vitro-Oozytenreifung (IVM) als Alternative für diese Patientinnen vorgeschlagen, da sie keine Triggerinjektionerfordert. In dieser Studie wurden 7 Frauen mit mindestens 3 Zyklen konventioneller IVF, bei denen keine reifen Eizellen gefunden wurden, untersucht. Alle unterzogen sich einer IVM, und bei 2 von ihnen wurde durch diese Technik eine Schwangerschaft erreicht.
Trotz dieses vereinzelten Artikels, der für Patienten mit echtem VFS ermutigend zu sein verspricht, sollte beachtet werden, dass die IVM eine unzureichend genutzte Technik ist und ihre Nützlichkeit in der Schwebe ist. Der Grund dafür ist, dass die Erfolgsquoten dieser Technik gering sind. Aus diesem Grund bieten nur wenige Kliniken ihren Patienten diese Behandlung an.
Fragen die Nutzer stellten
Warum kann eine leere Punktion auftreten?
Bei der Leerpunktion werden trotz ausreichendem Follikelwachstum keine Eizellen entnommen. Wenn diese Situation wiederholt auftritt, spricht man vom Leer-Follikel-Syndrom.
Einigen Studien zufolge kann dies bei bis zu 7 % der IVF-Patientinnen auftreten, obwohl es in den allermeisten Fällen auf Probleme mit der Medikation zurückzuführen ist (Verabreichungsfehler, abgelaufenes HCG oder verminderte Bioverfügbarkeit). Ein echtes Leere-Follikel-Syndrom tritt schätzungsweise nur bei 0,02 % der Patientinnen auf.
Die Ursache des Syndroms der leeren Follikel ist unklar, obwohl man annimmt, dass Störungen der Follikulogenese (Bildung von Follikeln und Eizellen) die Hauptursache sind, entweder aufgrund des mütterlichen Alters, schlechter Eizellenqualität oder genetischer Faktoren. Dies könnte dazu führen:
- Eine frühe Degeneration der Eizellen mit dem Ergebnis, dass bei der Punktion keine Eizellen vorhanden sind
- Eine fehlende Ablösung der Eizelle von der Follikelwand. Während des Eisprungs löst das luteinisierende Hormon eine Reihe von Mechanismen aus, die eine Aufweichung des Bindegewebes des Follikels bewirken, wodurch sich die Eizelle von der Follikelwand lösen kann.
Es wurde vorgeschlagen, den Zyklus mit rekombinantem HCG oder luteinisierendem Hormon zu wiederholen oder den Eisprung mit einem Gonadotropin-Releasing-Hormon-Agonisten in einem Zyklus mit Antagonisten auszulösen. Bleibt das Problem jedoch bestehen, kann eine Eizellspende eine Option sein.
Was ist die Ursache des Empty-Follicle-Syndroms?
Das Empty-Follicle-Syndrom tritt auf, wenn die Patientin die letzte Injektion der Stimulation korrekt verabreicht, aber nach der Punktion keine Eizellen gefunden werden. Der Grund für diese physiologische Reaktion auf die letzte Behandlungsinjektion ist nicht bekannt. Diese Reaktion tritt häufiger bei Frauen über vierzig Jahren und mit einer geringen Eierstockreserve auf.
In Anbetracht dieses Problems sollten die Fachärzte die Möglichkeit in Betracht ziehen, eine neue Behandlung mit einem anderen Stimulationsprotokoll zu beginnen oder in Fällen, die noch nicht geklärt sind, eine Eizellenspende vorzuschlagen.
Mehr lesen
Kann mein Zyklus der assistierten Reproduktion ruiniert werden, wenn ich das hCG nicht zum richtigen Zeitpunkt spritze?
Ja, der Erfolg der assistierten Reproduktion kann beeinträchtigt werden, wenn die hCG-Injektion falsch oder zum falschen Zeitpunkt verabreicht wird.
Diese Injektion ist die letzte Injektion vor der Follikelpunktion und wird 36 Stunden vor der Punktion verabreicht. Seine Verabreichung führt zu einem Anstieg des LH-Hormons, das die Reifung der Eizellen fördert, aber auch dazu, dass die Eizellen 38-40 Stunden nach der Verabreichung aus den Eierstöcken freigesetzt werden, ein Effekt, der unbedingt vermieden werden muss.
Ein Fehler beim Verabreichungszeitpunkt kann dazu führen, dass bei der Punktion aufgrund des False Empty Follicle Syndroms keine Eizellen entnommen werden, oder die Patientin hat bereits einen Eisprung.
Welche Alternativen gibt es für Patienten mit echtem Empty-Follicle-Syndrom?
Wenn es nach mehreren Zyklen der Stimulation der Eierstöcke nicht möglich ist, Eizellen zu gewinnen, und ein echtes Leerfollikelsyndrom diagnostiziert wird, ist die erste Option, die Kliniken für assistierte Reproduktion in der Regel empfehlen, eine Eizellenspende.
Auch die Möglichkeit einer In-vitro-Eizellreifung ist im Gespräch, doch wird diese Technik in den Zentren für assistierte Reproduktion nicht häufig angewandt.
Was sind die Symptome des Syndroms der leeren Follikel?
Das Empty-Follicle-Syndrom (VFS) hat keine Symptome. Daher ist es sowohl für Fachärzte als auch für die Patientinnen sehr frustrierend, wenn VFS während der Stimulationsphase der Eierstöcke nicht diagnostiziert werden kann. VFS kann nur diagnostiziert werden, wenn bei der Follikelpunktion keine Eizellen gewonnen wurden.
Es gibt jedoch eine Reihe von Maßnahmen, um dies bei wiederkehrenden Patientinnen zu verhindern: Sicherstellen, dass die Patientin die Anweisungen für die Medikamentenverabreichung verstanden hat, Erhöhung der hCG-Dosen, Wechsel des Stimulationsprotokolls oder der Medikamente und mehrmalige Aspiration desselben Follikels.
Für Sie empfohlen
Wie wir oben erläutert haben, gibt es viele Stimulationsprotokolle, die Ärzte bei ihren Behandlungen einsetzen. Die Rolle des Arztes besteht darin, die Patientin zu untersuchen und ein für sie geeignetes Stimulationsprotokoll auf der Grundlage ihrer Krankengeschichte zu erstellen. Wenn Sie eine Behandlung zur assistierten Reproduktion mittels Stimulation der Eierstöcke planen und mehr über dieses Verfahren wissen möchten, lesen Sie bitte unseren Artikel Was ist eine Stimulation der Eierstöcke - Ablauf, Medikamente und Symptome.
Ein weiteres Problem, mit dem Experten für assistierte Reproduktion in Fruchtbarkeitszentren häufig konfrontiert werden, ist ein Patient, der schlecht auf eine Hormonbehandlung anspricht. Wenn die Stimulation nur wenige oder qualitativ schlechte Eizellen hervorbringt, kann dies ein Hindernis für eine erfolgreiche Behandlung darstellen. Diese Situation tritt häufiger bei älteren Frauen auf, die das Kinderkriegen aufgeschoben haben. Low Responder in Stimulationsbehandlungen.
Wir bemühen uns, Ihnen Informationen von höchster Qualität zu liefern.
🙏 Bitte teilen Sie diesen Artikel, wenn er Ihnen gefallen hat. 💜💜 Helfen Sie uns, weiterzumachen!
Literaturverzeichnis
Hourvitz A, Maman E, Brengauz M, Machtinger R, Dor J. In vitro maturation for patients with repeated in vitro fertilization failure due to "oocyte maturation abnormalities". Fertil Steril. 2010;94(2):496-501.
Albano C, Grimbizis G, Smitz J, Riethmuller-Winzen H, Reissman T, Van Steirteghem A, Devroey P (1998). The luteal phase of non-supplemental cycles after ovarian superovulation with human menopausal gonadotropin and the gonadotropin-releasing hormone antagonist Cetrorelix. Fertil Steril;70:357 – 359.
Allegra A, Marino A, Coffaro F, Scaglione P, Sammartano F, Rizza G, Volpes A (2007). GnRH antagonist-induced inhibition of the premature LH surge increases pregnancy rates in IUI-stimulated cycles. A prospective randomized trial. Hum Reprod; 22: 101 – 108.
Arici A, Byrd W, Bradshaw K, Kutteh WH, Marshburn P, Carr BR (1994). Evaluation of clomiphene citrate and human chorionic gonadotropin treatment: a prospective, randomized, crossover study during intrauterine insemination cycles. Fertil Steril;61:314 – 318.
Baart EB, Martini E, Eijkemans MJ, Van Opstal D, Beckers NG, Verhoeff A, Macklon NS, Fauser BC (2007). Milder ovarian stimulation for in-vitro fertilization reduces aneuploidy in the human preimplantation embryo: a randomized controlled trial. Hum Reprod;22:980 – 988.
Balasch J, Ballescà JL, Pimentel C, Creus M, Fàbregues F, Vanrell JA (1994). Late low-dose pure follicle stimulating hormone for ovarian stimulation in intrauterine insemination cycles. Hum Reprod; 9: 1863– 1866
Batista MC, Cartledge TP, Zellmer AW, Nieman LK, Loriaux DL, Merriam GR (1994). The antiprogestin RU486 delays the midcycle gonadotropin surge and ovulation in gonadotropin-releasing hormone-induced cycles. Fertil Steril;62:28 – 34
Beckers NGM, Macklon NS, Eijkemans MJ, Ludwig M, Felderbaum RE, Diedrich K, Bustion S, Loumaye E, Fauser BCJM (2003). Non supplemented luteal phase characteristics after the administration of recombinant human chorionic gonadotropin, recombinant luteinizing hormone, or gonadotropin-releasing hormone (GnRH) agonist to induce final oocyte maturation in in vitro fertilization patients after ovarian stimulation with recombinant follicle-stimulating hormone and GnRH antagonist cotreatment. J Clin Endocrinol Metab; 88:4186 – 4192.
Bhattacharya S, Harrild K, Mollison J, Wordsworth S, Tay CCK, Harrold A, McQueen D, Lyall H, Johnston L, Burrage J et al. (2008). Clomiphene citrate or unstimulated intrauterine insemination compared with expectant management for unexplained infertility: pragmatic randomised controlled trial. BMJ;337:716 – 723.
Braat DD, Schoemaker J (1991). Endocrinology of gonadotropin-releasing hormone induced cycles in hypothalamic amenorrhea: the role of the pulse dose. Fertil Steril;56:1054– 1059.
Cantineau AE, Cohlen BJ. Dutch IUI Study Group (2007), The prevalence and influence of luteinizing hormone surges in stimulated cycles combined with intrauterine insemination during a prospective cohort study. Fertil Steril;88:107– 112.
de Koning J, Lambalk CB, Helmerhorst FM, Helder MN (2001). Is GnRH self-priming an obligatory feature of the reproductive cycle? Hum Reprod;16:209– 214.
Dickey RP, Taylor SN, Lu PY, Sartor BM, Rye PH, Pyrzak R (2002). Effect of diagnosis, age, sperm quality, and number of preovulatory follicles on the outcome of multiple cycles of clomiphene citrate-intrauterine insemination. Fertil Steril;78:1088 – 1095.
Dickey RP, Taylor SN, Lu PY, Sartor BM, Rye PH, Pyrzak R (2005). Risk factors for higher order multiple pregnancy and multiple birth after controlled ovarian hyperstimulation; results of 4,062 IUI cycles. Fertil Steril; 83:671– 683.
DiLuigi AJ, Nulsen JC (2007). Effects of gonadotropin-releasing hormone agonists and antagonists on luteal function. Curr Opin Obstet Gynecol; 19:258– 265.
Dubourdieu S, Charbonnel B, D’Acremont MF, Carreau S, Spitz IM, Bouchard P (1994). Effect of administration of a gonadotropin-releasing hormone (GnRH) antagonist (Nal-Glu) during the periovulatory period: the luteinizing hormone surge requires secretion of GnRH. J Clin Endocrinol Metab;78:343 – 347.
Ecochard R, Mathieu C, Royere D, Blache G, Rabilloud M, Czyba JC (2000). A randomized prospective study comparing pregnancy rates after clomiphene citrate and human menopausal gonadotropin before intrauterine insemination. Fertil Steril;73:90 – 93
Fauser BCJM, Devroey P, Macklon NS (2005). Multiple birth resulting from ovarian stimulation for subfertility treatment. Lancet; 365:1807– 1816.
Ghesquiere SL, Castelain EG, Spiessens C, Meuleman CL, D’Hooghe TM. Relationship between follicle number and (multiple) live birth rate after controlled ovarian hyperstimulation and intrauterine insemination. Am J Obstet Gynecol 2007;197:589.e1– 5
Gleicher N, Oleske DM, Tur-Kaspa I, Vidali A, Karande V. Reducing the risk of higher order multiple pregnancy after ovarian stimulation with gonadotropins. N Engl J Med 2000;343:2 – 7
Gomez-Polomares JL, Juliia B, Acevedo-Martin B, Martinez-Burgos M, Hernandez ER, Ricciarelli E (2005). Timing ovulation for intrauterine insemination with a GnRH antagonist. Hum Reprod;20:368 – 372
Guzick DS, Carson SA, Coutifaris C, Overstreet JW, Factor-Litvak P, Steinkampf MP, Hill JA, Mastroianni L, Buster JE, Nakajima ST et al. Efficacy of superovulation and intrauterine insemination in the treatment of infertility. N Engl J Med 1999;340:177 – 183.
Matorras R, Diaz T, Corcostegui B, Ramon O, Pijoan JI, Rodriguez-Escudero FJ. Ovarian stimulation in intrauterine insemination with donor sperm: a randomized study comparing clomiphene citrate in fixed protocol versus highly purified urinary FSH. Hum Reprod 2002;17:2107 – 2111.
Coroleu B, Devesa M, y Álvarez M. Guía 18. Estimulación ovárica para FIV-ICSI en los ciclos con presunción de baja respuesta. Servicio de Medicina de la Reproducción Departamento de Obstetricia, Ginecología y Reproducción Hospital Universitario Quirón Dexeus, Barcelona. Sociedad Española de Fertilidad (SEF) y Sociedad Española de Ginecología y Obstetricia (SEGO)
Ferraretti AP et al. (2011). ESHRE consensus on definition of poor response to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod; 26: 1616-24.
Rodríguez Gálvez, I., Tocino Díaz, A., Fernández Sánchez, M. Fármacos en la estimulación ovárica: clomifeno, gonadotropinas, análogos GnRH, hCG. En: Unidad 06, Bloque I: Esterilidad femenina. Máster en Reproducción Humana de la Universidad Rey Juan Carlos y el Instituto Valenciano de Infertilidad (IVI).
Nelson SM. Biomarkers of ovarian response: current and future applications. Fertil Steril 2013; 99: 963-9.
Hamdine O. et al. (2015). Ovarian response prediction in GnRH antagonist treatment for IVF using anti-Müllerian hormone. Hum. Reprod.; 39: 170-8.
Griesinger G. y col. (2006). GnRH-antagonists in ovarian stimulation for IVF in patients with poor response to gonadotropins, polycystic ovary syndrome, and risk of ovarian hyperstimulation: a meta-analysis. Reproductive BioMedicine Online; 13: 628-638.
Edwards, R.G., Lobo, R. and Bouchard, P. (1996) Time to revolutionize ovarian stimulation. Hum. Reprod., 11, 917-919.
Emperaire, J.C. and Ruffle, A. (1991) Triggering ovulation with endogenous LH may prevent ovarian hyperstimulation. Hum. Reprod., 6, 506-510.
Lenton, E. (1993) Natural cycle versus stimulated cycle IVF. /. Assist. Reprod. Genet., 10,406-08
Jacob S., Drudy L., Conroy R. and Harrison R.E (1998): Outcome from consecutive in-vitro fertilization/ intracytoplasmic sperm injection attempts in the final group with urinary gonadotropins and the first group treated with recombinant follicle stimulating hormone. Hum. Reprod. 13: 1783-1787.
Celik H, Bıldırcın D, Güven D, Cetinkaya MB, Alper T, Batuoğlu S. Random anti-Müllerian
hormone predicts ovarian response in women with high baseline follicle-stimulating
hormone levels Anti-Müllerian hormone in poor responders in assisted reproductive
treatment. J Assist Reprod Genet, 2012; 29:797–802.
Ferraretti AP, La Marca A, Fauser BCJM, Tarlatzis B, Nargund G, Gianaroli L ESHRE
consensus on the definition of “poor response” to ovarian stimulation for in Vitro
fertilization: the Bologna criteria. Human Reproduction 2011; 26 (7): 1616-1624.
Delvigne A, Rozenberg S. Epidemiology and prevention of ovarian hyperstimulation syndrome (OHSS): a review. Hum Reprod Update. 2002; 8(6): 559-77.
Kably Ambe A, Estevez Gonzalez S, Carballo Mondragon E, Dura´n Monterrosas L. Comparative analysis of pregnancy rate/captured oocytes in an in vitro fertilization program. Ginecol Obstet Mex 2008; 76:256 – 260. Spanish
Lee KH, Kim SH, Jee BC, Kim YJ, Suh CS, Kim KC, Lee WD. Comparison of clinical characteristics between early and late patterns in hospitalized patients with ovarian hyperstimulation syndrome. Fertil Steril 2010; 93:2274 – 2280.
Letterie G, Marshall L, Angle M. The relationship of clinical response, oocyte number, and success in oocyte donor cycles. J Assist Reprod Genet 2005;22:115 – 117.
Meniru GI, Craft IL. Utilization of retrieved oocytes as an index of the efficiency of superovulation strategies for in-vitro fertilization treatment. Hum Reprod 1997;12:2129– 2132.
Molina Hita Ma. del M, Lobo Martinez S, Gonzalez Varea, Montejo Gadea JM, Garijo López E, Cuadrado Mangas C. Correlation between the number of oocytes and the pregnancy rate in IVF-ICSI cycles. Revista Iberoamericana de Fertilidad y Reproducción Humana 2008; 25:153 – 159. Spanish
López-Rioja MJ, Campos-Cañas JA, Recio-López Y, Quiroz-Garza G, Sánchez-González M, Hinojosa Rodríguez K, Laresgoiti Servitje E. Número óptimo de ovocitos: modelo de predicción para fertilización in vitro. Ginecol Obstet Mex. 2017 nov;85(11):735-747.
Fragen die Nutzer stellten: 'Warum kann eine leere Punktion auftreten?', 'Was ist die Ursache des Empty-Follicle-Syndroms?', 'Kann mein Zyklus der assistierten Reproduktion ruiniert werden, wenn ich das hCG nicht zum richtigen Zeitpunkt spritze?', 'Welche Alternativen gibt es für Patienten mit echtem Empty-Follicle-Syndrom?' Und 'Was sind die Symptome des Syndroms der leeren Follikel?'.
Autoren und Mitwirkende




Ich bin 35 Jahre alt und habe drei IVF-Zyklen hinter mir. Im ersten Zyklus wurde nur ein Follikel entnommen, und der war leer. Beim nächsten Mal wurden 6 Follikel entnommen, aber sie haben keine entnommen, und bei der letzten IVF waren alle Follikel leer. Mir wurde gesagt, dass es vielleicht an meinem Alter oder an einem Gendefekt liegt. Ich weiß nicht, was ich tun soll, ich habe lange darauf gewartet, und ich bin sehr enttäuscht.
Hallo Jenell,
Nach dem, was Sie uns erzählen, ist es möglich, dass Sie wirklich das Empty-Follicle-Syndrom haben, denn die Ursachen sind unbekannt. Aber es gibt Alternativen, um schwanger zu werden.
Durch die Ovodonation können Sie eine junge Eizelle von hoher Qualität erhalten, die Ihre Chancen auf eine Schwangerschaft erhöht. Ich empfehle Ihnen, den folgenden Artikel zu lesen: Wie funktioniert eine In-vitro-Fertilisation mit Eizellenspende?
Ich hoffe, ich habe Ihnen geholfen.
Mit freundlichen Grüßen.
Hallo, ich hatte gerade eine Punktion und es kam nur ein Follikel heraus, und der war leer. Ich habe mich vielen Tests unterzogen und alles scheint in Ordnung zu sein. Wie kann ich wissen, ob es sich um ein echtes oder ein falsches Follikelsyndrom handelt?
Hallo Ernestine 32,
Die Ursachen für das Entstehen eines leeren Follikels lassen sich durch eine fehlgeschlagene Stimulation der Eierstöcke erklären.
Um festzustellen, ob es sich wirklich um ein leeres Follikel handelt oder nicht, sollte die Stimulation wiederholt werden, wobei eine umfassende Kontrolle der kontrollierbaren Variablen zu berücksichtigen ist. Die nächste Punktion wird zeigen, ob das Follikel leer ist oder ob es das Ergebnis einer schlechten Stimulation ist.
Ich hoffe, ich habe Ihnen geholfen.
Mit freundlichen Grüßen.